Ben je geïnteresseerd in de wereld van wetenschap & technologie en wil je hier graag meer over lezen? Word dan lid van KIJK!
Gentherapie ontwikkelt zich in een razend tempo en de mogelijkheden lijken inmiddels eindeloos.
De Amerikaanse Voedsel- en Warenautoriteit (FDA) heeft de eerste gentherapie op basis van stamcellen goedgekeurd. Dat wil zeggen dat het de eerste officiële behandeling is waarbij stamcellen worden verwijderd, genetisch gemodificeerd, en vervolgens teruggebracht in een patiënt. Met een prijs van 2,8 miljoen dollar (zo’n 2,75 miljoen euro) per persoon is Zynteglo, zoals de medische behandeling heet, ook de duurste ooit.
Lees ook:
Waarom gentherapie?
Ons lijf is opgebouwd uit grofweg 100.000 miljard cellen die er gezamenlijk voor zorgen dat alles naar behoren werkt. Om dat te doen, hebben ze wel eiwitten nodig. Als je je een cel als een fabriek voorstelt, zijn eiwitten de werkers die deze fabriek draaiende houden. Ze weten wat ze moeten doen omdat ze een handleiding tot hun beschikking hebben die te vinden is in de celkern: ons DNA.
De genen waaruit ons DNA is opgebouwd, zetten precies uiteen wat er van de eiwitten wordt verwacht. En dan is er ook nog zoiets als RNA. Zie dat als een tussenpersoon: RNA kopieert het DNA, treedt buiten de celkern en maakt daar de eiwitten aan, precies zoals het DNA dat voorschrijft. Maar soms zit er een foutje in een of meerdere genen. En als de handleiding niet klopt, gaat het in de uitvoering ook mis. In dat geval praat je over een genetische aandoening. Gentherapie kan deze foutjes corrigeren.
Bèta-thalassemie
De gentherapie is ontwikkeld voor mensen met de zeldzame bloedziekte bèta-thalassemie. Patiënten met de erfelijke aandoening lijden aan chronische bloedarmoede, doordat het lichaam het eiwit hemoglobine niet goed aanmaakt. Hemoglobine transporteert zuurstof van je longen naar de rest van je lichaam en voert koolstofdioxide juist af.
Momenteel krijgen mensen met bèta-thalassemie veel bloedtransfusies, om de hoeveelheid rode bloedcellen – die voor een groot deel bestaan uit hemoglobine – weer aan te vullen. Maar het gevaar hiervan is dat de patiënten te veel ijzer binnenkrijgen, waardoor het zich gaat opstapelen in het lichaam – en dat is ook gevaarlijk.
Gentherapie
Gentherapie is een veelbelovend alternatief. In dit geval wordt een goed werkende variant van het defecte gen ingebracht in de stamcellen van de patiënt, die de taken van het defecte gen overneemt. Een arts haalt de cellen uit de patiënt en brengt ze naar het lab. Daar worden vervolgens de juiste genen toegevoegd, gebruikmakend van een virus, waarna de patiënt ze ‘terugkrijgt’.
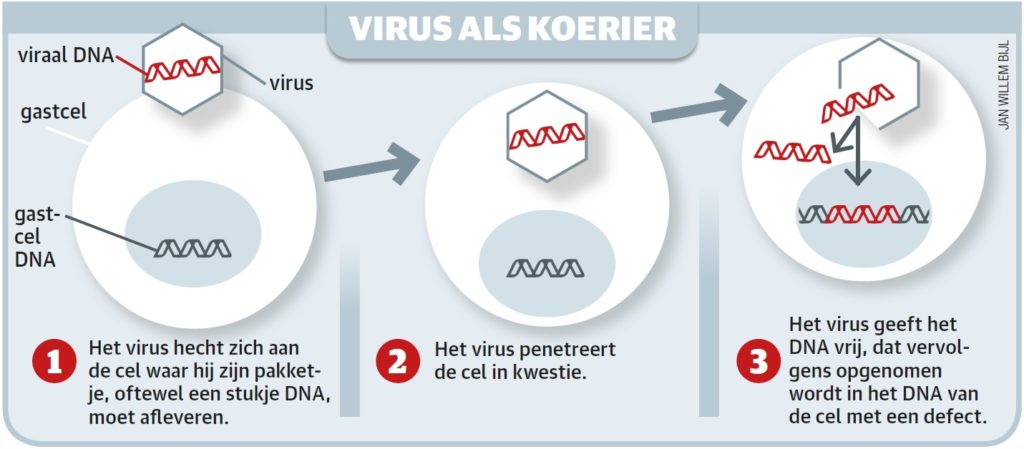

De genetisch gemodificeerde stamcellen kunnen dankzij deze aanpassing veranderen in rode bloedcellen die wél het eiwit hemoglobine hebben. De effecten van de eenmalige behandeling houden naar verwachting een leven lang aan.
Nadelen
Zynteglo zou veel bèta-thalassemiepatiënten van de bloedtransfusies af kunnen helpen. Toch zitten er ook risico’s vast aan de behandeling. In klinische proeven waarbij soortgelijke gentherapieën werden getest, zijn bijvoorbeeld gevallen van leukemie gerapporteerd. Daarom beveelt de FDA patiënten aan om gedurende vijftien jaar na de behandeling hun bloed geregeld te laten controleren. Er zijn echter geen gevallen van kanker waargenomen in studies over Zynteglo, meldt de FDA.
Dan is er nog de prijs van 2,75 miljoen euro per behandeling. Bèta-thalassemie, en veel andere erfelijke aandoeningen als SCID, waarbij baby’s zonder immuunsysteem worden geboren, zijn zeldzaam. Bovendien is de behandeling eenmalig. Dat betekent dat er niet veel winst valt te halen voor de fabrikant en dus wordt de prijs flink opgeschroefd.
Wrang
“Op zich is dit een belangrijke mijlpaal voor stamcel gebaseerde gentherapie en voor thalassemie-patiënten”, zegt hoogleraar moleculaire stamcelbiologie Frank Staal. “Het is een dure therapie, maar de kosten ervan zijn ook hoog en het is een levensreddende eenmalige behandeling die in principe veiliger is, en beter lijkt te zijn dan de huidige behadelingen.” Toch geeft Staal toe dat bijna 3 miljoen wel erg fors is.
“Het wrange vind ik vooral dat dit middel volledig in Europa is ontwikkeld in EU-projecten. De vector (het virus dat het gen bij het juiste ‘adres’ aflevert, red.) is in Italië en Frankrijk ontwikkeld, maar is nu niet beschikbaar in Europa.” Dit komt onder meer door het zeer ingewikkelde Europese netwerk van regelgeving, dat veel complexer en duurder is dan in de VS, legt Staal uit.
“In Europa zou het middel dus nog duurder moeten worden. Dit is iets dat ik met collega’s probeer te veranderen in ons NWA-project CURE4LIFE dat ik coördineer.” Dit consortium wil gentherapieën sneller naar de patiënt brengen. “Overigens is dit niet de enige gentherapie die om niet-medische redenen niet beschikbaar komt voor patiënten. Erg naar.”
Bronnen: FDA, New Atlas, KIJK Zomernummer 2020
Beeld: VCHAL/iStock/Getty Images


