Ben je geïnteresseerd in de wereld van wetenschap & technologie en wil je hier graag meer over lezen? Word dan lid van KIJK!
Mitochondriën zijn de energiefabriekjes van onze cellen. Wat nou als we die uit gezonde cellen halen en injecteren in beschadigd weefsel? Zwitserse wetenschappers werken eraan.
Even de biologieles oprakelen. Organismen waarvan de cellen minstens één kern bevatten, noemen we eukaryoten. Wij mensen zijn er een voorbeeld van. Maar eukaryoten kunnen niet overleven zonder mitochondriën: de centrales die onze cellen voorzien van energie. In bijna alle lichaamscellen zijn de energiefabriekjes te vinden: ze bevatten 500 tot 2000 mitochondriën.
De belangrijke functie die de organellen (celorgaantjes) vervullen, betekent ook dat wanneer het fout gaat, dit ernstige gevolgen kan hebben voor het functioneren van organen. Daarom onderzoeken wetenschappers al enige tijd of het mogelijk is om mitochondriën te transplanteren van de ene gezonde naar de andere beschadigde cel.
Lees ook:
Transplantatie
Het idee van een mitochondriale transplantatie, zoals de medische naam luidt, is niet nieuw. In zeldzame gevallen is de methode zelfs al toegepast om beschadigde harten van pasgeboren baby’s te behandelen, waarbij het hartweefsel een oppepper heeft gekregen van de gezonde energiefabriekjes. Toch blijft het klinisch gebruik van de transplantatie beperkt, omdat het slagingspercentage nog te laag was. Daar hopen wetenschappers van de ETH Zürich verandering in te brengen.
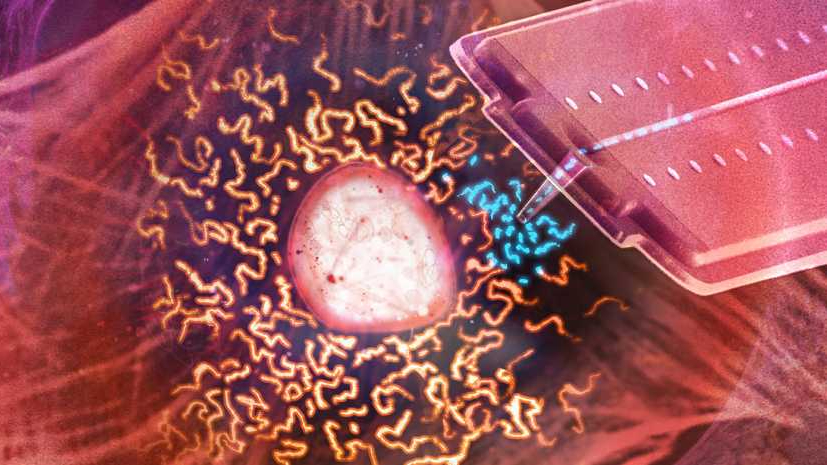
Ze ontwikkelden een cilindervormige nanospuit waarmee ze heel secuur het celmembraan kunnen doorboren zonder dat de lichaamscel daardoor sterft. Vervolgens zuigen ze enkele mitochondriën op en injecteren die in een andere cel. Zo’n minuscuul spuitje kunnen de onderzoekers natuurlijk niet zelf hanteren, dat doen ze met behulp van een laser en een atoomkrachtmicroscoop. En dankzij een drukregelaar kunnen ze kleine volumes vloeistof van een femtoliter (of een quadriljoenste liter) opzuigen uit een cel.
In laboratoriumtests bleek dat de getransplanteerde mitochondriën een overlevingspercentage van meer dan 80 procent hadden. Eenmaal in de nieuwe cellen duurde het tussen de 20 minuten en 12 uur voordat de mitochondriën versmolten met een bestaand draadvormig netwerk van andere mitochondriën.
De inhoud op deze pagina wordt momenteel geblokkeerd om jouw cookie-keuzes te respecteren. Klik hier om jouw cookie-voorkeuren aan te passen en de inhoud te bekijken.
Je kan jouw keuzes op elk moment wijzigen door onderaan de site op "Cookie-instellingen" te klikken."
Je kan jouw keuzes op elk moment wijzigen door onderaan de site op "Cookie-instellingen" te klikken."
Wetenschappers geholpen
“Dit is ontzettend interessant, het transplantaren van mitochondriën geeft wetenschapper veel opties”, laat Koen Hendriks van het Universitair Medisch Centrum Groningen weten. “Dit is vroeger met een wat omslachtigere techniek al geprobeerd (en gelukt!), maar op deze manier een stuk eenvoudiger gemaakt. Daarmee is de methode, indien goed onder controle, toe te passen voor veel meer wetenschappers en onderzoeksvragen.”
Zelf doet Hendriks ook onderzoek naar mitochondriën, maar dan in winterslapers, zoals de hamster. “Hamstercellen overleven, dankzij een soort van winterslaap, koeling en andere cellulaire stress veel beter dan menselijke cellen. Dit lijkt te komen door de mitochondriën. Een hamstermitochondrion in een mensencel in het lab kan dus helpen inzicht te geven over de exacte mechanismes daarachter. Uiteindelijk kan dat inzicht helpen voor het ontwikkelen van nieuwe medicijnen en therapieën. Met mij kunnen ongetwijfeld veel meer wetenschappers nu iets dergelijks in het lab onderzoeken met deze techniek.”
En kunnen menselijke organen ermee worden ‘opgelapt’? Zo is bekend dat donororganen niet direct functioneren na een transplantatie, mede doordat de mitochondriën niet altijd op gang komen. Kan een mitochondriale transplantatie daar verandering in brengen? Hendriks: “Die optie is een stuk lastiger. Deze techniek heeft daarvoor twee grote nadelen.” Ten eerste moeten de orgaancellen één voor één andere mitochondriën krijgen. “Voor de transplantatie betekent dat dus dat de cellen uit een orgaan zouden moeten, door een machine, en weer terug naar het orgaan: geen handige optie dus. Een ander groot nadeel (ook voor de wetenschap overigens), is dat met deze techniek er wel een nieuw stukje mitochondriaal DNA wordt toegevoegd, maar het oude ook nog blijft bestaan. Als het oude mitochondrion schade maakt doordat het stuk is, komt er wel wat nieuws bij, maar het blijft alsnog bestaan.”
Al met al een leuke techniek die echt tot de verbeelding spreekt en de wetenschap verder kan helpen, besluit Hendriks. “Maar voor orgaantransplantatie zie ik voorlopig te grote problemen.”
Bronnen: PLOS Biology, ETH Zürich, New Atlas
Beeld: Artistieke impressie van mitochondriale transplantatie met een speciaal ontwikkelde nanospuit © Sean Kilian